Kemija
Jesenski rok 2010.
U sljedećim zadacima dopunite tablice ili rečenice upisivanjem pojmova koji nedostaju.
6. Kalcit je glavni sastojak sedimentnih stijena poput vapnenca. Vapnenac uglavnom nastaje iz ljušturica uginulih morskih organizama, primjerice, planktona.
Žarenjem kalcita dobiva se tvar B i bezbojni plin C.
6.1. Napišite jednadžbu kemijske reakcije žarenja kalcita i označite agregacijska stanja reaktanata i produkata.
______________________________________________________________
6.2. Napišite kemijske nazive tvari B i plina C.
6.2.1. Tvar B ______________________________________________
6.2.2. Plin C ______________________________________________
6.3. Izračunajte koliki bi bio volumen plinovitoga produkta nastaloga žarenjem 50 kg kalcita pri 0 °C i pri tlaku od 1013 hPa.
Postupak:
Rezultat: ____________________
Točni odgovori:
6.1. CaCO3(s) → CaO(s) + CO2(g)
6.2.1. Tvar B kalcijev oksid

6.2.2. Plin C ugljikov(IV) oksid
6.3. Postupak:
n(kalcit) = 50 kg / 100 g mol−1 = 500 mol
n(kalcit) = n(CO2) = 1 : 1
V(CO2) = n(CO2) · Vm = 500 mol ∙ 22,4 dm3 mol−1 = 11 200 dm3
Rezultat: V(CO2) = 11,2 m3

7. Reakcijom kalcijeva oksida s vodom nastaje tvar koja mijenja boju crvenoga lakmus papira u plavu.
7.1. Napišite jednadžbu kemijske reakcije kalcijeva oksida s vodom u velikome suvišku i označite agregacijska stanja reaktanata i produkata.
______________________________________________________________
7.2. Doda li se tekućini koja nastaje reakcijom kalcijeva oksida i vode sumporna kiselina, doći će do kemijske reakcije i nastat će nova tvar. Napišite jednadžbu te kemijske reakcije i označite agregacijska stanja reaktanata i produkata.
______________________________________________________________
7.3. Napišite kemijski naziv soli koja nastaje kemijskom reakcijom opisanom u zadatku 7.2.
______________________________________________________________
7.4. Nacrtajte Lewisovu strukturnu formulu aniona soli koja je nastala kemijskom reakcijom opisanom u zadatku 7.2.
Točni odgovori:
7.1. CaO(s) + H2O(l) → Ca(OH)2(aq)
7.2. Ca(OH)2(aq) + H2SO4(aq) → CaSO4(s) + 2 H2O(l)
7.3. Kalcijev sulfat
7.4.

8. Sumporov(IV) oksid može se katalitički oksidirati u sumporov(VI) oksid pri 575 °C uz uporabu platinske mrežice kao katalizatora. Ovu kemijsku promjenu može se opisati ovim izrazom:
2 SO2(g) + O2(g) → 2 SO3(g); ΔrH < 0.
8.1. Napišite izraz za tlačnu konstantu ravnoteže navedene oksidacije sumporova dioksida rabeći parcijalne tlakove reaktanata i produkata.
U sljedećim zadatcima strelicom udesno (→) označite ako će navedena promjena povećati ravnotežnu količinu produkata u reakcijskome sustavu, strjelicom ulijevo (←) ako će navedena promjena smanjiti količinu produkata u reakcijskome sustavu i crticom (−) ako navedena promjena ne utječe na ravnotežne količine reaktanata i produkata u reakcijskome sustavu.
8.2. Povišenje temperature reakcijskoga sustava

8.3. Povećanje tlaka u reakcijskome sustavu

8.4. Dodavanje kisika u reakcijski sustav

8.5. Objasnite kako katalizator utječe na kemijsku ravnotežu reakcijskoga sustava.
______________________________________________________________
______________________________________________________________
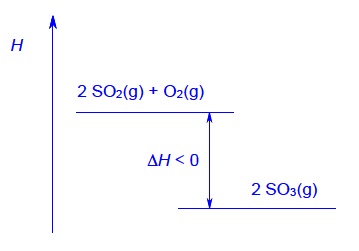
8.6. Nacrtajte entalpijski dijagram katalitičke oksidacije sumporova dioksida opisane izrazom:
2 SO2(g) + O2(g) → 2 SO3(g); ΔrH < 0.
Točni odgovori:
8.1.

8.2. ←
8.3. →
8.4. →
8.5.Katalizator ne mijenja ravnotežne koncentracije reaktanata i produkata već omogućuje njihovo brže postizanje (ostvarivanje), tj. ubrzava postizanje stanja dinamičke ravnoteže u reakcijskom sustavu.
8.6.

9. Na slici je prikazana strukturna formula molekule limunske kiseline.

9.1. Napišite molekulsku formulu molekule limunske kiseline.
_________________________________
9.2. Izračunajte maseni udio vodika u molekuli limunske kiseline.
Postupak:
Rezultat: _________________________________
9.3. Koliko je hidroksidnih iona potrebno za potpunu neutralizaciju jedne molekule limunske kiseline?
_________________________________
9.4. Prehrambeni aditiv čija je oznaka E333 je sol limunske kiseline, kalcijev citrat.
Napišite kemijsku formulu kalcijeva citrata.
_________________________________
9.5. Esterifikacija je poznata reakcija kiselina i alkohola.
Napišite jednadžbu kemijske reakcije esterifikacije metanske kiseline i etanola.
______________________________________________________________
9.6. Napišite kemijski naziv estera nastaloga reakcijom iz zadatka 9.5.
______________________________________________________________
Točni odgovori:
9.1. C6H8O7
9.2. w(H, C6H8O7) = 4,2%
9.3. 3 hidroksidna iona
9.4. Ca3(C6H5O7)2
9.5. HCOOH + CH3CH2OH → HCOOCH2CH3 + H2O
9.6. Etil-metanoat ili etil-formijat

10. Galvanski članak načinjen je od dvaju polučlanaka pri standardnome tlaku i pri temperaturi od 25 °C. Srebrna elektroda uronjena je u otopinu srebrovih(I) iona, a željezna elektroda u otopinu željezovih(II) iona.
E°(Ag+/Ag) = +0,799 V i E°(Fe2+/Fe) = –0,440 V
10.1. Napišite shemu toga galvanskoga članka.
______________________________________________________________
10.2. Napišite kemijske reakcije na elektrodama.
10.2.1. Katoda: _________________________________________________
10.2.2. Anoda: _________________________________________________
10.3. Napišite sumarnu jednadžbu kemijske reakcije ovoga galvanskoga članka.
______________________________________________________________
10.4. Izračunajte razliku potencijala ovoga galvanskoga članka.
Postupak:
Rezultat: ______________
10.5. Jedan od načina zaštite metalnih predmeta od korozije je zaštita prevlakama od plemenitih metala. Uroni li se čelična šipkica u rastaljeno srebro, nastat će srebrna prevlaka koja će dobro štititi šipkicu od korozije.
Što će se dogoditi ako se zaštitni sloj ošteti, a predmet se nalazi u vlažnoj atmosferi? Obrazložite.
______________________________________________________________
______________________________________________________________
______________________________________________________________
______________________________________________________________
Točni odgovori:
10.1. Fe(s) │ Fe2+(aq) ¦¦ Ag+(aq) │ Ag(s)
10.2.1. Katoda: Ag+(aq) + e− → Ag(s)
10.2.2. Anoda: Fe(s) → Fe2+(aq) + 2 e−
10.3. 2 Ag+(aq) + Fe(s) → 2 Ag(s) + Fe2+(aq)
10.4. Račun:
ΔE = E°katoda − E°anoda = (+0,799 V) – (– 0,44 V) = +1,239 V
Rezultat: ΔE = 1,239 V
10.5. Ošteti li se zaštitna prevlaka, korozija će se pojačati. Redukcijski potencijal željeza značajno je negativniji od redukcijskog potencijala srebra, pa nastaje korozijski članak u kojem je željezo anoda te će se još lakše oksidirati nego da nema srebra.
Pitanja i odgovori preuzeti sa stranice Nacionalnog centra za vanjsko vrednovanje obrazovanja.