Državna matura 2010.
Ljetni rok
Ispitna pitanja i odgovori iz biologije

Zaokružite točan odgovor
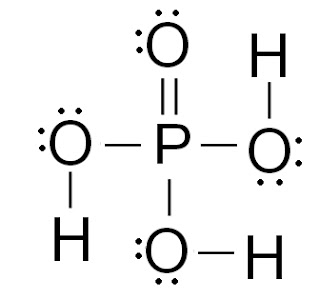
1. Koju molekulu prikazuje slika?

a) nukleotid
b) peptid
c) fosfolipid
d) steroid
Točan odgovor: A
2. Koju biste od navedenih tvari uporabili za dokazivanje bjelančevina u mlijeku?
a) etanol
b) Lugolovu otopinu
c) octenu kiselinu
d) aceton
Točan odgovor: C
3. Koji postupak opisuje kulturu stanice?
a) razdvajanje staničnih dijelova centrifugiranjem
b) uzgoj stanica izvan organizma na hranidbenoj podlozi
c) ugradnja radioaktivnih izotopa u stanične molekule
d) mikroskopiranje stanica elektronskim mikroskopom

Točan odgovor: B
4. Što od navedenoga nastaje kao rezultat mejoze u biljaka?
a) gameta
b) spora
c) sjemenka
d) sporofit
Točan odgovor: B
5. Koji je dio mikroskopa na slici označen slovom A.?

a) okular
b) objektiv
c) kondenzor
d) zrcalo
Točan odgovor: B
6. Odaberite ispravno poredane faze u razvoju nove jedinke nakon oplodnje
a) zigota – morula – gastrula – blastula
b) morula – blastula – zigota – gastrula
c) morula – zigota – gastrula – blastula
d) zigota – morula – blastula – gastrula
Točan odgovor: A
Točan odgovor: D
7. Odaberite ispravno poredane stanične tvorbe od najmanje prema najvećoj.
a) ribosom – lizosom – Golgijevo tijelo – jezgra
b) lizosom – ribosom – jezgra – Golgijevo tijelo
c) ribosom – Golgijevo tijelo – jezgra – lizosom
d) lizosom – ribosom – Golgijevo tijelo – jezgra
Točan odgovor: A
8. Koja je od navedenih sistematskih kategorija niža od roda?
a) vrsta
b) porodica
c) razred
d) red
Točan odgovor: A
9. U kojim se mjernim jedinicama uobičajeno izražava veličina virusa?
a) u angstremima
b) u mikrometrima
c) u nanometrima
d) u pikometrima
Točan odgovor: C
10. Koju od navedenih bolesti uzrokuju virusi?
a) trbušni tifus
b) antraks
c) tuberkulozu
d) dječju paralizu
Točan odgovor: D