Primjer 1. Prikažite elektronsku strukturu molekule dušika (N2).
Elektronska konfiguracija valentne ljuske atoma dušika je:
Elektronska konfiguracija valentne ljuske atoma dušika je:
ili 2s22p3
U valentnoj ljusci ima tri nesparena elektrona. U molekuli dušika stvorit će se tri zajednička elektronska para.
Središnji atom je sumpor koji ima 6 valentnih elektrona.
Atom sumpora veže se s dva atoma kisika jednostrukom kovalentnom vezom i postiže oktet,a s preostala dva atoma kisika koordinativno – kovalentnom vezom.
U nekim molekulama zajednički elektronski par potječe od jednog atoma i takva veza se naziva koordinativno – kovalentna veza. Prije se označavala strelicom.
Dva atoma kisika koja su vezana s atomom sumpora kovalentnom vezom, postići će oktet stvaranjem zajedničkih elektronskih parova s atomima vodika.
Formula sumporne kiseline često se prikazuje i ovako:
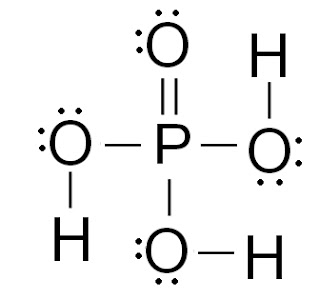
Primjer 3. Lewisovom simbolikom prikažite molekulu fosforne kiseline H3PO4.
Središnji atom je fosfor s 5 valentnih elektrona.
Središnji atom je fosfor s 5 valentnih elektrona.
Atom fosfora povezat će se s atomima kisika kovalentnom vezom:
1. Lewisovom simbolikom prikažite molekule:
a) vodika (H2)
b) kisika (O2)
c) klora (Cl2)
d) broma (Br2)
2. Lewisovom simbolikom prikažite povezivanje vodika sa svim halogenim elementima.
4. Napišite Lewisove strukture za molekule:
a) CH3Cl
b) CH3CH2OH
c) SO2
d) CO
e) H2S








Nema komentara:
Objavi komentar
Napomena: komentar može objaviti samo član ovog bloga.